摘要
流感病毒会激活细胞炎症小体通路,这对感染结果有利有弊。在这里,我们研究了炎性体激活的孔形成蛋白gasdermin D(GSDMD)在感染过程中的功能。与野生型(WT)小鼠相比,尽管病毒载量相似,但基因敲除(KO)小鼠(Gsdmd −/− )中GSDMD的消减能显著减轻流感病毒引起的体重下降、肺功能障碍、肺组织病理学和死亡率。感染 Gsdmd −/− 的小鼠肺转录组学显示炎症基因特征减少。其中,KO 小鼠肺部中性粒细胞弹性蛋白酶和髓过氧化物酶的检测减少证实了中性粒细胞基因激活特征的减少。事实上,在体内可观察到直接感染的中性粒细胞,而体外中性粒细胞感染会诱导 DNA 和组织破坏酶的释放,这在很大程度上依赖于 GSDMD。感染 WT 小鼠的中性粒细胞消耗再现了在 Gsdmd −/− 动物中观察到的死亡率、肺部炎症和肺部功能障碍的降低,而在 Gsdmd −/− 小鼠中消耗中性粒细胞并不具有额外的保护作用。这些发现表明,GSDMD 具有促进肺部中性粒细胞反应的功能,这种反应会扩大流感病毒诱导的炎症和发病机制。针对 GSDMD/中性粒细胞轴可能为治疗严重流感提供一种治疗途径。
他人正在浏览的类似内容
导言
甲型流感病毒(IAV)感染仍然是对全球公共卫生的威胁,每年有近 10% 的世界人口受到季节性流行病的影响,而新出现的全球大流行仍然是一个无时不在的威胁 1,2 。严重的 IAV 感染通常都会引起剧烈的炎症免疫反应和组织损伤。事实上,已知 IAV 可引发多种炎症途径,包括通过多种机制激活细胞炎性体 3 。然而,炎性体的激活对病毒感染的结果是有利还是有害取决于具体情况 4,5,6,7,8,9 ,这可能表明炎性体激活下游的不同途径和分子具有不同的作用。
NLRP3 炎性体是 IAV 感染中特征最明显的炎性体之一,它的激活是一把双刃剑,既能产生有益作用,也能引起病理炎症 3,6 。NLRP3 基因敲除(KO)小鼠在感染 IAV 后表现出加速死亡,这种表型与保护性促炎细胞因子分泌减少有关 5 。另一方面,在感染后第 7 天通过化学抑制阻断 NLRP3 炎性体对流感病毒感染有益,而且还与炎性细胞因子和趋化因子分泌减少有关 6,10,11,12 。此外,我们以前的研究表明,用一种实验性治疗蛋白--重组人Mitsugumin 53(MG53,也称为TRIM72 13 )治疗IAV感染的小鼠,可显著降低发病率、死亡率和肺部炎症,这与NLRP3炎性体水平和活性的降低有关 14 。这些先前的研究共同表明,虽然炎性体的某些功能可能是有益的,但在 IAV 感染期间,炎性体的过度激活会导致病理变化和死亡。
Gasdermin D(GSDMD)是一种被炎症体激活的 Caspases 分解的效应蛋白,可使释放的 N 端 GSDMD 片段组装成寡聚体,在质膜上形成孔 15,16 。GSDMD 孔介导特定促炎细胞因子(即 IL-1 和 IL-18 17,18,19 )的释放,可促进白细胞募集和病毒清除 20,21,22 ,但未解决的孔形成可导致细胞猝死 15,23,24,25 。尽管 GSDMD 具有这些重要功能,但人们对其在病毒发病机制中的作用研究甚少。体外研究表明,GSDMD 对小鼠适应性流感病毒株感染诱导的巨噬细胞死亡并不重要,而对细胞因子和趋化因子反应的影响则未进行研究 8 。在动物模型的病毒发病机理研究中,很少对 GSDMD 进行研究 4,9,26 。鉴于 GSDMD 是炎症和化脓过程的驱动因子,因此有必要进一步研究 GSDMD 在体内病毒感染过程中驱动炎症的作用。
在本研究中,我们使用 Gsdmd −/− 小鼠探讨了 GSDMD 在 IAV 感染中的功能。与野生型 (WT) 小鼠相比,这种小鼠在病毒感染期间的肺部炎症、肺功能障碍和总体死亡率均有所下降,中性粒细胞活化和肺部炎症也受到抑制。在没有 GSDMD 的情况下,炎症的减轻不会影响病毒载量或阻碍感染后的恢复。我们的研究发现,GSDMD 是降低病理中性粒细胞活性和流感病毒感染严重程度的潜在靶点。
成果
降低感染 IAV 的 Gsdmd −/− 小鼠的发病率和死亡率
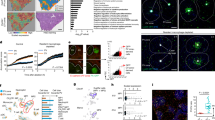
为了研究 GSDMD 在 IAV 感染过程中的作用,我们用 IAV 毒株 A/Puerto Rico/8/34 (H1N1)(以下简称 PR8)感染了雌性 WT 小鼠和 Gsdmd −/− 小鼠。我们的研究主要使用雌性小鼠,因为与雄性小鼠相比,雌性小鼠感染 PR8 的严重程度更高 27 。我们首先在感染后第 7 天通过 Western 印迹法检测肺部的 GSDMD 水平,包括指示活化的裂解 GSDMD N 端片段。正如预期的那样,在感染的 WT 小鼠肺部检测到了裂解的 GSDMD 14 ,而在模拟感染的 WT 小鼠肺部只能看到全长的 GSDMD(图 1A)。在受感染的 Gsdmd −/− 小鼠肺中检测不到 GSDMD,证实了这些动物的基因消减(图 1A)。Gsdmd −/− 小鼠的体重下降明显少于 WT 小鼠(图 1B),但值得注意的是,病情最严重的 WT 小鼠死于感染,从而掩盖了 GSDMD 缺乏在后期时间点的全部保护作用。事实上,60% 的 WT 小鼠死于感染或达到体重减轻超过 30% 的人道终点标准,而 Gsdmd −/− 动物的这一比例约为 10%,这表明 GSDMD 缺乏时具有保护作用(图 1C)。我们接下来评估了 GSDMD 是否会影响病毒复制。我们发现 WT 小鼠和 KO 小鼠肺部的病毒滴度相似(图 1D),这表明 GSDMD 会导致 IAV 感染的发病率和死亡率,而不会直接影响病毒水平。
图 1:IAV 感染后,GSDMD 会促进炎症和发病率。
A-D WT 和 Gsdmd −/− 小鼠经鼻感染 50 TCID50 的 IAV 毒株 PR8。感染后第 7 天采集的肺裂解液的 Western 印迹。每个泳道代表一只小鼠的裂解物。B 失重测量(每个点是相对于第 0 天标准化为 100% 的单个小鼠体重的平均值,误差条表示 SEM,模拟:n = 4 WT 和 Gsdmd −/− ,来自一次实验;IAV 感染:n = 21 WT,n = 20 KO,来自 3 个独立实验,P 值由双向方差分析和 Bonferroni 多重比较检验确定,仅显示感染组间的统计比较)。C 同 B 中一样,来自 3 个独立实验的生存曲线(P 值通过对数秩曼特尔-考克斯检验)。D 从模拟感染、感染后第 3 天(来自 1 个实验)或感染后第 7 天(来自 2 个独立实验)的肺匀浆中提取的病毒滴度(每个点代表一只小鼠,n = 3 个模拟,n = 6 个第 3 天 WT 和 KO,n = 11 个第 7 天 WT 和 Gsdmd −/− ,误差条表示 SEM)。NS,经双向方差分析和 Tukey's 多重比较检验无显著性,仅显示第 3 天和第 7 天 WT 与 Gsdmd −/− 的统计比较。原始数据见原始数据文件。
GSDMD 增加了 IAV 感染期间的肺部病理和功能障碍
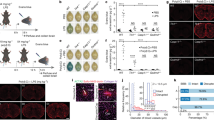
为了进一步探索 IAV 感染期间 GSDMD 缺乏所提供的保护作用,我们通过全身胸透 28 测量了 WT 和 KO 小鼠在整个感染时间过程中的增强暂停(PenH)值,该值是气道阻力的替代指标。WT 和 KO 小鼠的 PenH 值在感染后都有所增加,并在感染后第 7 天达到峰值(图 2A)。然而,Gsdmd −/− 小鼠的 PenH 值明显较低(图 2A),这表明 IAV 感染期间 GSDMD 的缺失对肺功能有益。感染后第 7 天,我们通过苏木精和伊红染色进一步检查了肺部切片。尽管所有受感染的肺切片都显示出细胞浸润和固缩区域,但与 Gsdmd −/− 的肺相比,WT 小鼠的肺显示出更严重的病理变化,肺泡间隔增厚、细胞堆积、开放的气腔更少(图 2B)。Gsdmd 9,29 小鼠肺部的病变情况与 Gsdmd 小鼠肺部的病变情况相比,肺泡间隔增厚,细胞堆积,开放气腔较少(图 2B)。与 WT 小鼠相比,通过这种无偏量化方法,Gsdmd −/− 小鼠的肺部病理变化确实明显减少(图 2C)。我们接下来研究了 GSDMD 缺失的保护性益处是否延伸至雄性小鼠。我们观察到,雄性小鼠的感染不那么严重,体重适度减轻,没有死亡病例,而且 Gsdmd −/− 小鼠在感染期间的体重减轻程度平均低于 WT 小鼠(补充图 1A)。此外,与雌性小鼠类似(图 2A),雄性 Gsdmd −/− 小鼠在肺功能方面也表现出显著的统计学优势,如 PenH 值所示(补充图 1B)。我们的研究结果总体上表明,GSDMD 的缺失会减轻 IAV 诱导的雌性和雄性小鼠肺部病理变化。随后的实验使用了更严重的雌性小鼠感染系统,以便有一个强大的动态范围来观察 WT 小鼠和 Gsdmd −/− 小鼠之间的表型和机理差异。
图 2:GSDMD 会加剧 IAV 感染后的肺功能障碍和病理变化。
A-C WT 和 Gsdmd −/− 小鼠经鼻感染 50 TCID50 的 IAV 毒株 PR8。A 每日全身胸透增强暂停(PenH)测量值(每个点代表多只小鼠的平均值,模拟:n = 4 WT 和 Gsdmd −/− (来自一次实验),IAV 感染:n = 18 WT,n = 17 Gsdmd −/− (来自 3 次独立实验),误差条表示 SEM,P 值由 WT IAV 与 Gsdmd −/− IAV 的双向方差分析及 Bonferroni 多重比较检验确定,其他比较未显示)。B 感染后第 7 天 WT 和 Gsdmd −/− 小鼠的代表性 H&E 图像。插图显示细胞浸润和炎症的放大区域。刻度线代表 2 毫米。C 多只 IAV 感染动物整个肺部切片的 H&E 染色中合并组织与开放气腔的量化(每个点代表一只小鼠,n = 8 只 WT 小鼠和 n = 7 只 Gsdmd −/− 小鼠,误差条表示 SEM(*p < 0.05,通过双尾非配对 t 检验)。原始数据见原始数据文件。
Gsdmd 小鼠对 IAV 感染的炎症转录反应减弱 -/-
为了更好地了解导致 WT 和 Gsdmd −/− 动物存活率和肺损伤差异的潜在机制,我们比较了 WT 和 Gsdmd −/− 小鼠感染 IAV 后的全局基因转录反应。感染后第 7 天对肺部 mRNA 总表达量的定量测量显示,WT 和 Gsdmd −/− 动物的转录特征各不相同,主成分分析显示了这一点(图 3A)。差异基因表达分析(折叠变化 |3 | ,p-adj <0.01)发现,与感染 Gsdmd −/− 的小鼠相比,感染 WT 的小鼠中有 812 个基因的表达量有所增加,而 Gsdmd −/− 中有 447 个基因的表达量相对于 WT 小鼠有所增加,共有 1259 个差异表达基因(图 3B,补充数据 1)。基因表达的层次聚类显示,相对于 Gsdmd −/− 小鼠,受感染的 WT 小鼠的基因表达高度上调(黄色聚类)和中度上调(红色聚类)(图 3C)。基因本体富集显示,高度和中度上调的基因都与炎症和抗病毒反应相关的生物过程相对应(图 3D)。相对于 Gsdmd −/− 小鼠(橙色群),在 WT 感染小鼠中被抑制的基因(如 Kcnh2、Scn5a 和 Sgcg)被发现与肌肉功能有关。基因组富集分析和网络分析进一步证实,在 IAV 感染中,由于 GSDMD 的缺失,与炎症和细胞因子信号转导相关的生物过程受到抑制(图 3E)。
图 3:GSDMD 在 IAV 感染中促进炎症基因表达程序。
A-E WT 和 Gsdmd −/− 小鼠以 50 TCID50 的剂量感染 IAV 毒株 PR8。感染后第 7 天,从 n = 3 WT 和 Gsdmd −/− 小鼠肺部提取 RNA 并进行 RNA 测序。A 比较 WT 和 Gsdmd −/− 肺部 RNA 测序结果的主成分分析。每个点代表一只小鼠。B 比较 WT 与 Gsdmd −/− 小鼠的差异基因表达的火山图(lfc |1.5 | ,使用 DEseq2 确定 adj p 值 < 0.01)。红色,812 个基因在 WT vs KO 中上调;蓝色,447 个基因在 WT vs Gsdmd −/− 中下调。C 不同表达基因的分层聚类。热图表示相对基因表达,红色表示表达上调的基因,蓝色表示表达下调的基因,每列代表一只小鼠。簇颜色表示与受感染的 Gsdmd −/− 小鼠相比,受感染的 WT 小鼠中表达模式相似的基因。D 每个簇内基因的基因本体分析。条形图代表 C 中每个群组内富集的前 10 个 GO 术语,用颜色表示。条形图长度代表显著富集通路的-log10 调整后 p 值(通过基因本体的 topGO 富集分析,-Log10 adj p 值 > 1.3)。E 通过基因组富集分析富集的 GO 生物过程术语网络。节点大小代表每个通路中的基因数量。边代表 GO 生物过程术语之间共享基因的数量。颜色表示富集得分,其中橙色表示 WT 感染肺相对于 Gsdmd −/− 肺的转录特征的正得分,蓝色表示负得分。
GSDMD 缺失可减少 IAV 感染期间的炎症反应
对 RNA 测序数据的进一步分析表明,在 Gsdmd −/− 肺中,与病毒感染的炎症防御反应有关的基因表达量减少(图 4A)。这组基因包括干扰素(IFNs)、IFN 刺激的趋化因子和经典的抗病毒 IFN 刺激基因,如 MX 和 OAS 家族基因(图 4A,补充数据 2)。我们利用已发表的免疫细胞特异性数据库(PanglaoDB)对差异表达基因进行了功能富集分析,发现 Gsdmd −/− 小鼠肺部与髓系细胞相关的基因显著减少(补充图 2A)。与此同时,通过 GO 生物过程分析(图 4B,补充数据 2)以及 REACTOME 和 IPA 经典通路分析(补充图 2B、C)发现,在 WT 与 Gsdmd −/− 样本中,参与中性粒细胞趋化的生物通路出现了富集。这些中性粒细胞相关基因包括一些细胞因子、趋化因子和受体,其中 Ccl1 是下调最明显的基因(图 3B、4B)。这些结果可能表明中性粒细胞数量减少或招募的中性粒细胞活化程度降低 30 。为了证实这些转录组学结果,我们对来自其他模拟或 IAV 感染动物的肺部 RNA 进行了 qRT-PCR,以测量一系列炎症基因的表达。我们广泛证实,感染 Gsdmd −/− 的小鼠与 WT 小鼠相比,炎症基因(包括 Ccl1、Cxcl9、Tnf 和 Ifnb1 等)的表达量减少,而在未感染的情况下则未观察到基线差异(图 4C)。我们通过测量分泌因子进一步证实了炎症细胞因子和趋化因子基因表达的衰减。我们观察到,与 WT 肺相比,Gsdmd −/− 的趋化因子 CCL1 明显减少(图 4D),这与我们在基因表达检测中观察到的该趋化因子的显著变化一致(图 4B、C)。Gsdmd −/− 小鼠的促炎细胞因子水平也有所降低,包括 IL-6、IFNβ、TNF、IL-1β 和 IL-18(图 4D)。这些结果与已确定的 GSDMD 在促进 IL-18 和 IL-1β 17,18,19 释放方面的作用一致,也与我们的 RNA 测序结果一致,该结果表明 KO 肺中的 IL-1 信号传导受到了抑制(图 3D)。总之,这些 RNA 测序、qRT-PCR 和 ELISA 结果广泛确定了 Gsdmd −/− 小鼠感染 IAV 期间炎症反应的减少。
图 4:Gsdmd −/− 小鼠中 IAV 引发的炎症有所减轻。
A、B 进一步分析了图 3 中的 RNAseq 结果。A 根据 GO 生物过程定义的与病毒响应相关的最高差异调节基因热图。B 根据 GO 生物过程定义的与中性粒细胞趋化有关的顶级差异调控基因热图。C 在感染 50 TCID50 IAV 毒株 PR8 后第 7 天,通过 qRT-PCR 对 WT 小鼠和 Gsdmd −/− 小鼠肺部目标基因的相对转录量进行量化(每个点代表一只小鼠,误差条表示 SEM,Mocks:n = 3,IAV 感染:n = 5,来自 1 个实验,样本独立于用于 RNAseq 的样本,P 值由单向方差分析确定,然后进行 Tukey's 多重比较检验,仅显示感染 WT 和 Gsdmd −/− 之间的比较)。D ELISA 定量模拟感染者、感染后第 3 天(来自 1 个实验)、感染后第 5 天(来自 1 个实验)或感染后第 7 天(来自 2 个独立实验)肺匀浆中 TNF、IL-6、IFNβ、IL-1β、IL-18 或 CCL1 的水平(每个点代表一只小鼠,Mocks:n = 3,IAV 第 3 天:n = 6,IAV 第 5 天:n = 5,IAV 第 7 天:n = 9,误差条表示 SEM,P 值由双向方差分析确定,然后进行 Tukey's 多重比较检验,仅显示第 7 天感染的 WT 和 Gsdmd −/− 之间的比较)。原始数据见原始数据文件。
由于已知 GSDMD 能介导巨噬细胞中细胞因子的释放和裂解,我们研究了人 THP-1 巨噬细胞对 PR8 或 H3N2 IAV 季节性分离物的反应,无论是否有 shRNA 靶向 GSDMD 水平。我们观察到,尽管 Western 印迹中的病毒核蛋白水平表明感染水平相当,但在 GSDMD 敲除(KD)巨噬细胞的上清液中,IL-1β、IL-6、TNF 和 IFNβ 水平均有所下降(补充图 3A-C)。我们还观察到 WT 和 GSDMD KD 细胞在感染后裂解 PARP1 水平升高,这表明 GSDMD 缺失并不能广泛阻止感染诱导的细胞死亡(补图 3A),尽管 GSDMD KD 细胞中乳酸脱氢酶释放减少(补图 3D)。我们的数据总体表明,在 GSDMD 缺失的情况下,IAV 诱导的炎症反应会受到抑制。
GSDMD 的缺失会减少 IAV 感染期间的中性粒细胞活化程序
我们对全局基因表达数据进行了进一步分析,发现在感染 IAV 的 Gsdmd −/− 与 WT 小鼠中,与中性粒细胞胞外陷阱形成、NOD 样受体信号转导和中性粒细胞脱颗粒相关的基因组显著减少(图 5A、B),这表明中性粒细胞活性降低可能是 Gsdmd −/− 小鼠发病机制减弱的原因之一。因此,我们使用流式细胞术检测了 GSDMD 是否参与了感染期间中性粒细胞向肺部的招募(补充图 4)。令人惊讶的是,我们发现 WT 小鼠和 Gsdmd −/− 小鼠在感染后第 7 天均表现出肺部中性粒细胞的强力招募,在每肺中性粒细胞数量(图 5C)或中性粒细胞相对于 CD45 免疫细胞总数的百分比(补充图 5)方面没有观察到基因型之间的统计学差异。我们还观察到其他先天性免疫细胞群,如嗜酸性粒细胞、巨噬细胞或自然杀伤细胞也被招募到肺部,同样,适应性 CD4 和 CD8 T 细胞及 B 细胞的招募在 Gsdmd + −/− 动物中也没有受到影响(补充图 5,补充图 6A)。我们还测量了感染后第 3 天肺部的免疫细胞募集情况,发现 WT 小鼠和 Gsdmd −/− 小鼠的细胞浸润极少,两者之间没有差异(图 5C、补充图 5、补充图 6A)。感染后第 7 天,对肺部切片的造血免疫细胞标记 CD45 染色证实,WT 和 KO 动物的肺部都有淋巴细胞聚集(补充图 6B)。因此我们假设,尽管 Gsdmd −/− 小鼠肺部的中性粒细胞数量相似,但中性粒细胞的功能可能会降低。为了验证这一点,我们测量了中性粒细胞弹性蛋白酶的水平,这是一种由活化的中性粒细胞释放的蛋白水解酶,可降解细胞外基质并促进中性粒细胞胞外陷阱的形成 31,32,33 。与 WT 组织相比,感染 Gsdmd −/− 小鼠肺部活化中性粒细胞的这一指标明显下降(图 5D)。我们同样测量了髓过氧化物酶(一种由氮质中性粒细胞颗粒释放的分子,可催化产生已知会导致组织损伤的活性氧中间产物),发现它在 Gsdmd −/− 肺组织中也有所减少(图 5D)。因此,在 GSDMD 缺失的情况下,IAV 感染期间存在于肺部的活化中性粒细胞产物会减少。
图 5:在没有 GSDMD 的情况下,IAV 诱导的中性粒细胞功能降低。
A 对图 3 中的 RNAseq 结果进行分析,以创建热图,显示 KEGG 通路分析所定义的参与中性粒细胞胞外陷阱形成和 NOD 样受体信号转导的差异调控基因。B 对 WT 与 Gsdmd −/− 小鼠差异表达基因的 REACTOME 分析确定了中性粒细胞脱颗粒相关基因的差异。C 通过流式细胞术对模拟感染(来自 2 个独立实验)、感染后第 3 天(来自 1 个实验)或感染后第 7 天(来自 3 个独立实验)的小鼠肺部中性粒细胞浸润进行定量(每个点代表一只小鼠,n = 6 只模拟小鼠,n = 6 只第 3 天小鼠,n = 14 只第 7 天小鼠,误差条表示 SEM,NS,经双向方差分析和 Tukey's 多重比较检验无显著性差异)。D ELISA 定量模拟感染(来自 1 次实验)、感染后第 3 天(来自 1 次实验)或感染后第 7 天(来自 2 次独立实验)肺匀浆中的中性粒细胞弹性蛋白酶和髓过氧化物酶水平(每个点代表一只小鼠,n = 3 只模拟小鼠,n = 6 只第 3 天小鼠,n = 6 只第 7 天小鼠,误差条表示 SEM,p 值由双向方差分析和 Tukey 多重比较检验确定)。E 骨髓中性粒细胞的相对细胞外 DNA 在 IAV 感染后通过荧光强度读数进行量化(PR8,MOI = 10,每个数据点为 n = 9 的平均值,每种基因型有 3 只小鼠的细胞被检测,一式三份,误差条表示 SEM,*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001(通过两两比较后的 Bonferroni 多重比较检验确定,比较 WT IAV 与 Gsdmd −/− IAV,其他比较未显示)。F 每个感染孔的最大荧光强度与 E 中相同(p 值由双尾非配对 t 检验确定)。G 如 E 所示,通过 ELISA 对细胞上清液中的中性粒细胞产物进行定量(n = 9,细胞来自 3 只小鼠,一式三份,误差条表示 SEM,*p 值由单向方差分析确定,然后进行 Tukey's 多重比较检验)。原始数据见原始数据文件。
为了进一步研究 GSDMD 在中性粒细胞中的作用,我们接下来感染了从 WT 或 Gsdmd −/− 小鼠骨髓中富集的原发性中性粒细胞(富集情况见补充图 7)。感染后,WT 中性粒细胞培养基中的乙二胺同二聚体-1 荧光随着时间的推移而增加,表明在病毒暴露后发生了具有 NETosis 特征的 DNA 释放(图 5E、F)。有趣的是,在相同的时间过程中,Gsdmd −/− 中性粒细胞的 DNA 染色极少(图 5E、F)。与这些结果相印证的是,我们观察到感染后细胞上清液中中性粒细胞弹性蛋白酶和髓过氧化物酶的释放在很大程度上依赖于 GSDMD(图 5G)。鉴于之前有报道称中性粒细胞可直接感染流感病毒 34,35,36 ,也鉴于我们的体外实验结果表明这些细胞对病毒有直接反应(图 5E-G),我们试图证实中性粒细胞在体内可感染 IAV。通过在 Cre 诱导的荧光报告小鼠 37,38,39 中使用表达 PR8 的 Cre 重组酶,我们观察到肺泡巨噬细胞(IAV 的免疫细胞靶标)受到感染,同时还观察到表达 Cre 诱导的感染荧光报告的中性粒细胞群(补充图 8A)。我们进一步注意到,与未感染细胞相比,感染的中性粒细胞显示出更高的 MHCII 表面水平,这表明中性粒细胞在感染后被激活(补图 8B)。这些发现促使我们在之前进行的 WT 或 Gsdmd −/− 肺流式细胞术实验中重新评估中性粒细胞表面标记物。我们发现,无论是否感染,WT 和 Gsdmd −/− 中性粒细胞中 Ly6G、CD11b 和 Ly6C 的水平都没有变化(补充图 9A、B)。相反,WT 和 Gsdmd −/− 小鼠感染 IAV 后,肺中性粒细胞的平均 MHCII 平均荧光强度增加(补图 9A、B)。这些结果共同揭示了中性粒细胞在 IAV 感染后通过 GSDMD 依赖性和非依赖性途径被激活。重要的是,我们的 RNA 测序结果、体内嗜中性粒细胞产物的测量结果以及体外嗜中性粒细胞对 IAV 反应活性的检测结果均表明,在 IAV 感染期间,嗜中性粒细胞的功能(包括 DNA 和组织损伤酶的释放)依赖于 GSDMD。
中性粒细胞增加了 IAV 感染的炎症反应和死亡率
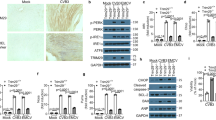
为了探究中性粒细胞活性减弱是否能解释我们在 Gsdmd −/− 动物身上观察到的流感病毒感染严重程度降低的原因,我们在 WT 小鼠感染早期就清除了中性粒细胞,并测量了感染结果。简而言之,我们用针对中性粒细胞的抗体(α-Ly6G)或同种型对照抗体处理小鼠,从感染后第3天开始,直到感染后第8天(图6A)。选择这一治疗时间表是为了在阻断过度的病理反应之前让急性中性粒细胞反应不受抑制地进行,同时也因为它代表了对中性粒细胞耗竭作为一种治疗策略的测试。我们通过测量感染后第 5 天α-Ly6G 处理小鼠肺部中性粒细胞总数的减少以及中性粒细胞与整个 CD45 免疫细胞群相比的相对百分比,证实了中性粒细胞的消耗(图 6B,补充图 10A-C)。通过分析嗜酸性粒细胞和肺泡巨噬细胞的总计数和百分比,进一步证实了中性粒细胞消耗的特异性。(补充图 10A-C)。在检测两组小鼠的发病率时,中性粒细胞耗竭小鼠因流感病毒引起的体重下降明显少于同种型对照组(图 6C)。值得注意的是,中性粒细胞耗竭对致死性感染具有完全的保护作用,而我们观察到同种型对照组小鼠的致死率为 60%(图 6D),这一结果与 Gsdmd + −/− 小鼠的保护作用相吻合(图 1C)。
图 6:中性粒细胞会加重流感的严重程度。
A IAV 感染(50 TCID50)和(B-I)抗体注射示意图。B 通过流式细胞术观察第 5 天 n = 5 只 WT 和 Gsdmd −/− 小鼠肺部的中性粒细胞数量(每个点代表一只小鼠,误差带表示 SEM,P 值通过双尾非配对 t 检验)。C 每组 n = 7 只小鼠的体重减轻(每个点是相对于第 0 天标准化为 100% 的单个小鼠体重的平均值,误差条表示 SEM,*p < 0.05,*p < 0.01,***p < 0.0001,通过双向方差分析,然后进行 Bonferroni 多重比较检验)。D 存活率分析。E 肺匀浆中的病毒滴度,每组 n = 5(每个圆点代表一只小鼠,误差带表示 SEM,WT 和 Gsdmd −/− 样本之间的差异无统计学意义,通过双向方差分析和 Tukey's 多重比较检验)。F 对感染后第 7 天的肺匀浆进行 ELISA 测量,每组 n = 5 只(每个点代表一只小鼠,P 值通过双尾非配对 t 检验确定)。G 感染 WT 和 Gsdmd −/− 小鼠的存活率分析,处理方法同 (A),每组 n = 6。H n = 6 只小鼠的体重减轻(每个圆点是相对于第 0 天归一化为 100% 的单个小鼠体重的平均值,误差条表示 SEM,*p < 0.05,通过双向方差分析,然后进行 Bonferroni 多重比较检验,星号表示与 WT-Isotype 比较的各自颜色编码)。彩色线条对应的组别如 (G)。I 通过全身胸透测量 PenH(每个圆点为 n = 6 只小鼠的平均值,误差条表示 SEM,*p < 0.05,通过双向方差分析,然后进行 Bonferroni 多重比较检验,星号表示与 WT-Isotype 的各色标比较)。彩色线条对应的组别如 (G)。B-F)中的数据代表一次实验,(G-I)中的数据代表另外一次独立实验。源数据文件中提供了源数据。
与 Gsdmd −/− 和 WT 小鼠的比较结果类似,在感染后第 5 天或第 7 天,中性粒细胞耗竭小鼠肺部的病毒滴度与同种型对照小鼠肺部的病毒滴度没有统计学差异(图 6E)。我们进一步观察到,与对照组相比,去中性粒细胞小鼠肺部的炎性细胞因子水平显著下降,包括 IL-1β、IL-6、IFNβ 和 TNF-α(图 6F)。同样,α-Ly6G 处理后 CCL1 水平也相应降低(图 6F)。这些结果表明,中性粒细胞总体上增强了 IAV 感染肺部的炎症反应。最后,我们对α-Ly6G处理小鼠和同型对照处理小鼠肺部的中性粒细胞弹性蛋白酶进行了量化,以进一步证实中性粒细胞弹性蛋白酶是中性粒细胞存在和活性的标志物。事实上,我们发现α-Ly6G 处理小鼠肺中的中性粒细胞弹性蛋白酶降低了(图 6F),这加强了我们在 Gsdmd −/− 与 WT 小鼠中发现的类似变化的数据(图 5D)。这些结果表明,中性粒细胞在 IAV 感染的肺部提供了炎症的整体增效作用。
为了进一步了解 IAV 感染期间 GSDMD 缺失所提供的保护是否由中性粒细胞介导,我们在 IAV 感染期间耗尽了 WT 和 Gsdmd −/− 动物体内的中性粒细胞(补图 11)。我们再次观察到,中性粒细胞耗竭或 GSDMD 的缺失可保护小鼠免于死亡和体重严重下降(图 6G、H)。中性粒细胞耗竭的 Gsdmd −/− 小鼠同样在感染中存活,但在体重减轻方面并未显示出比单独使用 Gsdmd −/− 更多的益处(图 6G、H)。我们还通过这些小鼠的全身胸透测量肺功能。在 WT 同型对照组小鼠中,表明气道阻力的 PenH 因感染而增加(图 6I)。中性粒细胞耗竭的 WT 小鼠、Gsdmd −/− 对照组小鼠和中性粒细胞耗竭的 Gsdmd −/− 小鼠的肺功能均下降较少,与 WT 对照组处理的小鼠相比,肺功能可更快地恢复到基线水平(图 6I)。重要的是,与体重下降的测量结果类似,我们没有观察到 Gsdmd −/− 与中性粒细胞耗竭相结合会带来额外的益处(图 6I)。这些胸透测量结果表明,中性粒细胞耗竭可在 IAV 感染期间保护肺功能,这与 IAV 感染期间 GSDMD 的炎症性肺损伤效应在很大程度上是由中性粒细胞介导的这一观点是一致的。总之,我们的研究结果表明,流感病毒感染期间肺部的中性粒细胞活动在很大程度上依赖于 GSDMD,中性粒细胞会放大 IAV 感染期间的炎症反应和肺功能障碍。
讨论
我们发现炎性体效应器 GSDMD 对流感病毒感染的结果有不利影响。在缺乏 GSDMD 的情况下,小鼠的发病率和死亡率降低,尽管肺部的病毒负荷未受影响。事实上,GSDMD 会导致肺部炎症、中性粒细胞活性和肺功能障碍。与 WT 小鼠相比,Gsdmd −/− 小鼠感染 IAV 后的预后有所改善,这与多种组织损伤性炎症通路的整体转录减少有关。此外,在没有 GSDMD 的情况下,中性粒细胞活性基因表达程序受损与疾病预后改善相关,我们随后通过外源消耗这些免疫细胞证实了这一点。虽然中性粒细胞耗竭与 GSDMD 的基因消减并不等同,但我们注意到,它们在 IAV 感染结果方面的表型相似,都是减轻体重、提高存活率、改善肺功能和减轻肺部炎症,且不影响病毒滴度。这些数据与 GSDMD 依赖性中性粒细胞活动驱动流感病毒发病机制的模型相一致。支持这一模型的其他数据包括1)Gsdmd −/− 肺部中性粒细胞脱颗粒释放的组织破坏性酶(中性粒细胞弹性蛋白酶和髓过氧化物酶)水平降低;2)Gsdmd −/− 肺部中与活化的中性粒细胞相关的基因表达降低(例如,KEGG NETosis、REACD、REACD)、3)体外纯化的 Gsdmd −/− 中性粒细胞的功能降低(NETosis 和脱颗粒),以及 4)证明 Gsdmd −/− 小鼠中性粒细胞的耗竭不会影响 IAV 诱导的体重减轻或肺功能,这表明这些 KO 小鼠的中性粒细胞没有功能。在控制流感病毒感染结果的免疫细胞类型中,中性粒细胞是最先浸润感染部位的细胞之一 40 。中性粒细胞的有益功能包括吞噬活性、细胞因子和趋化因子释放以及中性粒细胞胞外陷阱的形成,这些功能传统上与抗菌活动有关,但也能促进抗病毒状态 41,42,43,44,45 。相反,其他研究则强调了中性粒细胞无节制招募的潜在有害影响,其特点是过度炎症和肺损伤 4,46,47,48,49,50 。越来越多的研究表明,中性粒细胞的过度活动是导致不良疾病结局的一个驱动因素,我们的数据为这些研究增添了新的内容 46,47,48,50 。
虽然 GSDMD 对 IAV 复制或感染结果的影响研究不多,但它在其他情况下对巨噬细胞和中性粒细胞发挥重要作用的特性已得到充分证实 51 。事实上,在几种细菌感染中,巨噬细胞的脓细胞死亡以及 IL-1 和 IL-18 的释放广泛依赖于 GSDMD 51 。我们对 THP-1 巨噬细胞的体外研究结果表明,在感染 IAV PR8 株或季节性 H3N2 株后,GSDMD 的耗竭会导致促炎细胞因子的分泌减少。中性粒细胞的抗菌反应也依赖于 GSDMD,但据报道,GSDMD 孔主要形成于中性粒细胞的颗粒膜和自噬膜上,而不是质膜上 52 。这使得中性粒细胞弹性蛋白酶逃逸到细胞质中,从而催化 GSDMD 的非规范裂解,并通过自噬依赖机制进一步促进 IL-1β 的释放 52 。GSDMD 在中性粒细胞中的这种独特的前馈功能可能也与它在细菌挑战期间的 NETosis 中的关键作用有关 33,53 。我们的实验还表明,在 IAV 感染期间,GSDMD 可促进中性粒细胞的功能。虽然 GSDMD 的消减可能会抑制 IAV 在巨噬细胞和中性粒细胞中诱导的炎症过程,但我们的中性粒细胞耗竭实验表明,中性粒细胞的活动在介导 IAV 感染中的过度炎症和组织损伤方面尤为重要。
IAV 感染是导致成人急性呼吸窘迫综合征(ARDS)的最常见原因之一 54 。ARDS 的发展以双侧水肿和供氧恶化为特征 55 ,而导致这些标准的一个主要因素是为控制复制病毒而激活的细胞免疫反应所引起的不受约束的炎症。具体来说,中性粒细胞的浸润和数量与 ARDS 的严重程度相关 56 ,中性粒细胞分泌的组织破坏酶(如中性粒细胞弹性蛋白酶和髓过氧化物酶)和炎性细胞外捕获物会加剧 ARDS 的恶化 54 。同样,在 LPS 诱导的 ARDS 模型中,由 GSDMD 促成的 NETosis 最近被确定为疾病进展的驱动因素 57 。事实上,全身 Gsdmd −/− 小鼠在细菌性败血症模型中显示出更高的存活率,这种表型与炎症和 NET 形成的减少有关 58 。然而,在一项后续研究中,中性粒细胞特异性缺失 GSDMD 竟然导致致死率增加 59 。中性粒细胞通常对细菌感染的清除至关重要,而我们的数据显示,中性粒细胞的缺失并不影响肺部 IAV 滴度。因此,虽然中性粒细胞在两种类型的感染中都会扩大炎症,但中性粒细胞在细菌性疾病和病毒性疾病中的功能可能并不完全相似。未来使用中性粒细胞特异性 GSDMD 基因缺失的研究可能会提供更多关于该蛋白在 IAV 感染期间中性粒细胞反应中的作用的信息。
虽然 GSDMD 是炎症小体激活所启动的热蛋白沉积途径中的一种效应蛋白,但其他中间蛋白也可能对 IAV 感染的结果有所影响。事实上,Caspase-1/11 KO 小鼠的急性病加重,对流感病毒的适应性免疫力下降 60,61 。在 IAV 感染过程中,肺部 GSDMD 的激活是否需要特定的 Caspases,仍有待研究。有趣的是,中性粒细胞弹性蛋白酶也被证明能够裂解和激活 GSDMD 33,62 ,这可能解释了 Caspase-1/11 缺陷与 Gsdmd −/− 在 IAV 感染中的不同结果。
感染后,Gsdmd −/− 小鼠肺中的 IL-1β 和 IL-18 水平降低,但这些细胞因子的水平并不完全依赖于 GSDMD,尽管 GSDMD 在 IL-1β 和 IL-18 释放中发挥着典型作用 17,18,19 。这些结果表明,在 IAV 感染期间,这些细胞因子的释放存在部分冗余机制。事实上,这些结果与我们已发表的研究结果一致,即感染 SARS-CoV-2 后第 2 天肺部的 IL-1β 水平依赖于 GSDMD,但在感染后较晚的时间点,IL-1β 的释放不依赖于 GSDMD 9 。有趣的是,我们发现 GSDMD 的缺失对 SARS-CoV-2 疾病的严重程度没有显著影响 9 ,这凸显了 SARS-CoV-2 与 IAV 所激活的病理机制的惊人差异,值得进一步研究。此外,我们还发现 GSDMD 在 IAV 感染过程中促进 IFNβ 的表达和产生,这进一步表明这种效应蛋白除了释放典型炎性体相关分子外,还能增强促炎反应。在 Gsdmd −/− 小鼠中减弱包括 IFNβ 在内的几种促炎细胞因子通路对病毒复制没有明显影响。然而,IFNs 的病理和组织损伤效应会在其抗病毒作用达到顶峰后继续累积,这一点已得到公认 63,64,65 。我们的数据表明,在 IAV 感染期间,GSDMD 的缺失会平衡炎症反应,使其向组织损伤较小的表型发展,同时维持足以对抗病毒复制的反应。事实上,在修改我们的手稿期间,发表了一份报告,其中独立生成的 Gsdmd −/− 小鼠品系在受到高剂量 H3N2 IAV 的挑战时,与 WT 动物相比,可免受病毒诱导的致死,而对病毒载量的影响微乎其微 26 。据报道,GSDMD 对中性粒细胞招募到肺部有轻微影响 26 。未来的研究可能会发现 GSDMD 的更多细微作用,这取决于不同病毒株的致病性和剂量。
总之,我们发现 GSDMD 会在 IAV 感染期间促进炎症基因程序、组织损伤性中性粒细胞活动和肺部病理变化。重要的是,虽然 GSDMD 会加重病情,但它对感染后的恢复(包括肺功能的恢复)并无作用,因此它有望成为 IAV 感染期间宿主定向治疗的候选靶点。
方法
我们的研究符合所有相关的伦理法规,并获得了俄亥俄州立大学机构生物安全委员会(IBC)和机构动物护理与使用委员会(IACUC)的批准。
病毒库
流感病毒毒株 A/Puerto Rico/8/34 (H1N1) (PR8, 由西奈山伊坎医学院的 Thomas Moran 博士提供) 和 A/Victoria/361/2011 (H3N2, 由 BEI Resources, NR-44042 提供)在 10 天胚胎鸡卵 (Charles River Laboratories) 中繁殖,并按照之前的描述进行滴定 66 。在 MDCK 细胞中生长的 PR8-Cre 39 由 Ryan Langlois 博士(明尼苏达大学)友情提供。所有病毒均在 MDCK 细胞上滴定。
小鼠研究
男性和女性 Gsdmd−/−
由 Russell Vance 博士(加州大学伯克利分校)培育的 C57BL/6 J 背景小鼠67
小鼠购自杰克逊实验室(Strain # 032663)。WT 对照 C57BL/6 J 小鼠也购自杰克逊实验室(Strain # 000664)。具有阻止红色荧光蛋白tdTomato转录的loxP-fanked终止密码子的雌性小鼠购自杰克逊实验室(B6.Cg-Gt(ROSA)26Sortm14(CAG-tdTomato)Hze/J,C57BL/6 J背景,品系#007914)。实验时,所有小鼠均为 8-12 周龄。小鼠饲养在俄亥俄州立大学的生物医学研究塔饲养室,温度保持在华氏 68-76 度,光暗周期为 12:12,湿度在 30-70% 之间。饲养小鼠时使用的是经高压灭菌的独立通风笼(Allentown)。小鼠自由食用辐照天然饲料(Evnigo Teklad Diet 7912)。反渗透纯净水由自动架式供水系统提供。笼子包括 1⁄4 英寸的玉米棒垫料(Bed-o-Cobs, The Andersons)和棉质方形筑巢材料。根据俄亥俄州立大学机构动物护理和使用委员会批准的方案,在异氟醚麻醉下对小鼠进行鼻内感染。小鼠感染剂量为 50 TCID50 PR8 或 250 TCID50 PR8-Cre。使用较高剂量的 PR8-Cre 是由于其相对于 PR8 的适度衰减。在中性粒细胞耗竭实验中,小鼠在感染后第 3 天腹腔注射 0.5 mg 抗小鼠 Ly6G 抗体(InVivoMAb,BE0075-1)或 0.5 mg 大鼠 IgG2a 同型对照、抗三硝基苯酚抗体(InVivoMAb,BE0089)。从感染后第 4 天到第 8 天,给小鼠注射 0.2 毫克相同的抗体。增强停顿(PenH)值通过全身肺部胸透(Buxco 小型动物全身胸透)测定。小鼠在感染前 3 天适应胸透室,每天 10 分钟。感染后第 0-14 天,将小鼠放入胸透室适应 5 分钟,然后读数 5 分钟。在 5 分钟的记录期间,每隔 10 秒测量一次 PenH 值,取 10 秒间隔的 PenH 值平均值,并表示为当天的 PenH 绝对值。为了确定肺滴度和细胞因子水平,在对 MDCK 细胞进行滴度或通过 ELISA 进行分析之前,收集组织并用 1 毫升 PBS 匀浆,然后速冻并保存在 -80 °C。TCID50 值采用 Reed-Muench 法计算。体重减轻超过 30% 是小鼠实验中人道终点安乐死的主要标准。所有实验均由俄亥俄州立大学 IACUC 批准,协议编号为 2016A00000051-R2。 本实验方案遵循美国国立卫生研究院(NIH)通过的《实验动物的护理和使用指南》(Guide for the Care and Use of Laboratory Animals)中规定的指导原则。
细胞培养和感染
所有细胞均在 37 °C、5% CO2 的湿润培养箱中培养。载体对照和 GSDMD KD THP-1 细胞由慢病毒 shRNA 介导靶向生成,由俄亥俄州立大学的 Amal Amer 博士慷慨提供。细胞保存在 RPMI 1640 培养基(Fisher Scientific 公司)中,辅以 10% EquaFETAL 牛血清(Atlas Biologicals 公司)。按照之前的描述 68 ,用 25 nM 磷酸肉豆蔻醋酸酯(PMA)处理 THP-1 细胞 3 天,使其分化成巨噬细胞。用PR8或H3N2病毒感染THP-1细胞,MOI为10,持续48小时,然后收集细胞进行Western印迹,或收集细胞介质测量细胞因子和LDH释放。MDCK 细胞(BEI Resources,NR-2628)在添加了 10% EquaFETAL 牛血清的 DMEM(Fisher Scientific)中生长。
体外骨髓中性粒细胞研究
根据 EasySep 中性粒细胞富集试剂盒推荐的方案(STEMCELL Technologies, 19762),从 WT 或 Gsdmd −/− 小鼠骨髓中阴性筛选中性粒细胞。中性粒细胞富集通过流式细胞仪进行确认。中性粒细胞NETosis的量化方法是将富集的中性粒细胞按30,000个细胞/孔的比例接种到96孔板中,并加入RPMI 1640培养基(Fisher Scientific公司)和4 μM乙二胺同二聚体-1(Invitrogen公司,L3224B)。立即用 MOI 10 的 PR8 感染这些细胞 200 分钟,其间每隔十分钟用 SpectraMax i3X 多模式微孔板阅读器(Molecular Devices)测量一次荧光强度(激发/发射最大值 528/617)。将不含乙啶均二聚体-1 的相同平板感染 6 小时,以测量细胞上清液中的中性粒细胞弹性蛋白酶和髓过氧化物酶。
Western 印迹
为了检测肺组织中的蛋白质表达,样本在含有磷酸酶蛋白酶抑制剂(Sigma,4906845001)和蛋白酶抑制剂(Thermo Scientific,A32965)的鸡尾酒的 1% SDS 缓冲液(1% SDS,50 mM triethanolamine pH 7.4,150 mM NaCl)中裂解。裂解液以 20,000 x g 离心 10 分钟,可溶性蛋白上清液用于 Western 印迹分析。等量蛋白质(30 μg)经 SDS-PAGE 分离后转移到膜上。用含 0.1% 吐温-20 的磷酸盐缓冲盐水(PBST)中的 10%脱脂牛奶对薄膜进行阻断,并用抗 GSDMD(1:1000,Abcam #ab219800;克隆 EPR20859)和肌动蛋白(1:1000,Abcam #ab3280;克隆 ACTN05 (C4))的抗体以及 HRP 结合的抗兔 IgG 二抗(1:10000,Cell Signaling Technologies (CST) #7074)进行探针检测。在对 THP-1 细胞进行 Western 印迹时,用 RIPA 缓冲液(150 mM NaCl;1% IGEPAL CA-630;0.5% 脱氧胆酸钠;0.1% SDS;50 mM Tris-HCl,pH 8.0)收集细胞裂解液,并加入 Benzonase 核酸酶和 HALT 蛋白酶及磷酸酶抑制剂。等量蛋白质(15-30 μg)经 SDS-PAGE 分离后转移到 PVDF 膜(BioRad)上。用含 0.1% 吐温 20 的三相缓冲生理盐水(TBST)稀释 5% 的牛奶阻断膜。在 TBST 中用 5% BSA 稀释的抗体孵育一抗过夜,然后在 TBST 中用 5% 牛奶稀释的物种特异性 HRP 结合物二抗孵育。使用了以下抗体裂解 PARP(Asp214)XP 兔 mAb(1:1000,CST #5625 S;克隆 D64E10)、单克隆抗流感 NP A/CA/04/09(H1N1)pdm(1:1000,BEI Resources #NR-19868;克隆 2F4)、GAPDH 兔 mAb(1:1000,CST #2118 L;克隆 14C10)、裂解 GSDMD(Asp275)兔 mAb(1:1000,CST #36425 S;克隆 E7H9G),人 GSDMD(1:1000,Abcam #ab210070;克隆 EPR19829),过氧化物酶亲和纯驴抗小鼠 IgG(H + L)(1:10,000,Jackson ImmunoResearch #715-035-150),过氧化物酶亲和纯驴抗兔 IgG(H + L)(1:10,000,Jackson ImmunoResearch #711-035-152)。使用 ChemiDoc Touch (BioRad) 采集化学发光图像。
RNA 提取和基因表达定量
用 TRIzol 试剂匀浆小鼠肺组织。用 1-溴-3-氯丙烷分离后,收集水相,用乙醇沉淀 RNA。使用 iScript cDNA Synthesis Kit(BioRad,#1708890)按照生产商的方案生成 cDNA。使用 iTaq Universal SYBR Green 试剂(BioRad)在 CFX-384 (BioRad) 仪器上以 Chmp2a 作为参考基因进行 mRNA 定量。本研究使用的引物购自 Integrated DNA Technologies,列于补充数据 3。
酶联免疫吸附试验
人 IL-1β、IL-6、TNF 和 IFNβ,以及小鼠 CCL1、TNF、IL-18、IFNβ、IL-1β、IL-6、中性粒细胞弹性蛋白酶和髓过氧化物酶 ELISA 是使用相应的 R&D Systems Duoset ELISA 试剂盒(目录编号 # DY201、DY206、DY814-05、DY845、DY410、DY7625-05、DY8234-05、DY401、DY406、DY4517-05 和 DY3667)。
流式细胞仪
用含有 Dnase I(Sigma Aldrich)和 IV 型胶原酶(Worthington Biochemical Corporation)的 GentleMACS C 管(Miltenyi)对模拟或感染的小鼠肺进行匀浆。使用 GentleMACS 设备将肺处理成单细胞悬浮液。用 CellBlox(Invitrogen 公司)对单细胞匀浆进行阻断,并按照生产商的说明使用 eFluor 780 固定活力染料(Invitrogen 公司,65-0865-14)进行活力染色。细胞洗净后用 Invitrogen 公司的 Ly6G(1:333,克隆 1A8-Ly6g,参考号 46-9668)、CD11b(1:333.克隆 M1/70,参考号 64-0112)、CD103(1:333,克隆 2E7,参考号 63-1031)、CD45R(1:333,克隆 RA3-6B2,参考号 12-0452)、MHCII(1:500,克隆 M5/114.15.2,参考号 78-5321)、CD8a(1:333,克隆 53-6.7,参考号 58-0081)、CD4(1:333,克隆 GK1.5,参考号 M001T02R02)、CD3e(1:333,克隆 17A2,参考号 367-0032-82)、CD69(1:333,克隆 H1.2F3,参考号 25-0691-82)、CD19(1:333,克隆 eBio1D3 (1D3),参考号 67-0193-82)、NK1.1(1:200,克隆 PK136,参考号 61-5941-82)和 Ly6C(1:200,克隆 HK1.4,参考号 48-5932-82)和 BioLegend 抗体(CD45.2,1:333,克隆 104,参考号 109838)、CD11c(1:333,克隆 N418,参考号 117320)和 Siglec F(1:100,克隆 S17007L,参考号 155524)冰浴 30 分钟。细胞用 BD FACS 裂解缓冲液在 4 ℃ 固定 10 分钟,在 PBS 中重悬,并在 Cytek Aurora 仪器上运行。在每个样本中加入计数珠(Invitrogen)以量化细胞总数。使用 FlowJo 软件(10.8.1)对样本进行分析。
组织学
肺组织样本在 10%中性缓冲福尔马林中 4 ℃ 固定 24 小时,然后转移到 70% 乙醇中。用石蜡包埋、切片、染色(H&E 和抗 CD45 染色),并用 Histowiz(Histowiz.com,美国纽约布鲁克林)成像。使用 ImageJ 软件和颜色去卷积法 9,29,69,70 对结果图像进行无偏电子量化。
RNA 测序和功能基因富集分析
使用 TRIzol(Invitrogen 公司)从肺组织中提取 RNA。RNA 文库制备和测序由 GENEWIZ 公司(GENEWIZ LLC./Azenta US, Inc South Plainfield, NJ, USA)进行,GENEWIZ 公司提供的方法如下:"使用 Qubit 2.0 Fluorometer(ThermoFisher Scientific, Waltham, MA, USA)对收到的 RNA 样品进行定量,并使用 TapeStation(Agilent Technologies, Palo Alto, CA, USA)检查 RNA 的完整性。使用用于 Illumina 的 NEBNext Ultra II RNA 文库制备试剂盒(New England Biolabs, Ipswich, MA, USA, #E7770S),按照生产商的说明制备 RNA 测序文库。简而言之,首先用 Oligod(T) 珠富集 mRNA。富集的 mRNA 在 94 °C 下破碎 15 分钟。将 cDNA 片段进行末端修复并在 3'end 处进行腺苷酸化,然后将通用适配体连接到 cDNA 片段上,接着添加索引,并通过有限循环的 PCR 进行文库富集。测序文库在 Agilent TapeStation(Agilent Technologies,Palo Alto,CA,USA)上进行验证,并通过 Qubit 2.0 荧光仪(ThermoFisher Scientific,Waltham,MA,USA)和定量 PCR(KAPA Biosystems,Wilmington,MA,USA)进行定量。测序文库被复用并聚类到流式细胞上。聚类后,按照制造商的说明将流式细胞装载到 Illumina HiSeq 仪器上。使用 2x150bp 配对端(PE)配置对样本进行测序。图像分析和碱基调用由 HiSeq 控制软件(HCS)进行。从 Illumina HiSeq 生成的原始序列数据(.bcl 文件)被转换成 fastq 文件,并使用 Illumina bcl2fastq 2.17 软件进行去多路复用。索引序列识别允许有一个错误匹配"。原始 fastq 文件由 ROSALIND 公司(ROSALIND, Inc. San Diego, CA, https://rosalind.bio/)开发的 HyperScale 架构进行处理、比对和量化。作为质量控制步骤的一部分,还生成了读数分布百分比、小提琴图、特征热图和样本 MDS 图。使用 ROSALIND 对差异基因表达进行统计分析。具体来说,使用 DESeq2 R 库通过相对对数表达对样本计数进行归一化。71
.DEseq2 也用于计算折叠变化和 p 值。主成分分析、火山图和热图使用 ROSALIND 提供的数值在 R 中进行格式化。基因本体分析使用 topGO R 软件包进行,以确定 GO 术语之间的局部相似性和依赖性,从而进行 Elim 剪枝校正。基因组富集分析(GSEA)采用已发表的方法进行。基因列表按表达量排序,并输入 GSEA 软件,使用 GO 生物过程数据库进行分析。72,73
.网络分析使用 Cytoscape74
.使用 REACTOME 数据库进行了其他分析75, PanglaoDB76 ,KEGG 数据库77
和 Ingenuity Pathway Analysis (Qiagen)。部分功能富集分析使用 Enrichr78,79.
报告摘要
有关研究设计的更多信息,请参阅本文链接的《自然组合报告摘要》。
数据可用性
RNA 测序原始数据以及处理后的基因表达矩阵(原始和归一化计数)已存入 NCBI GEO 数据库,登录代码为 GSE230656。图和补充图中 Western 印迹和图表的原始数据在源数据文件中提供。本文随附原始数据。
参考资料
Lee, S. S., Viboud, C. & Petersen, E. Understanding the rebound of influenza in the post COVID-19 pandemic period holds important clues for epidemiology and control.Int.J. Infect.Dis.122, 1002-1004 (2022).
Javanian, M. et al. 流感病毒感染简评。J. Med.Virol.93, 4638-4646 (2021).
Seveau, S. et al. 感染期间自噬与炎性体之间的制衡。J. Mol.430, 174-192 (2018).
Corry, J. et al. 炎性巨噬细胞和中性粒细胞的浸润以及肺部广泛的脓毒血症导致非人灵长类动物死于流感。PLoS Pathog.18, e1010395 (2022).
Allen, I. C. et al.免疫 30,556-565 (2009)。
Tate, M. D. & Mansell, A. An update on the NLRP3 inflammasome and influenza: the road to redemption or perdition?Curr Opin Immunol.54, 80-85 (2018).
Chung, W. C. et al. 甲型流感病毒 NS1 蛋白抑制 NLRP3 炎性体。PLoS One 10, e0126456 (2015)。
Kuriakose, T. 等人 ZBP1/DAI 是流感病毒的先天性传感器,可触发 NLRP3 炎性体和程序性细胞死亡途径。Sci.1, AAG2045 (2016).
Eltobgy, M. M. 等人,Caspase-4/11 通过促进炎症和免疫血栓形成加剧了 SARS-CoV-2 感染的疾病严重性。Proc.Natl.USA 119, e2202012119 (2022).
Tate, M. D. et al. 通过时间抑制重新评估 NLRP3 炎症小体在致病性甲型流感病毒感染过程中的作用。Sci. Rep. 6, 27912 (2016).
Ong, J. D., Mansell, A. & Tate, M. D. Hero turned villain:甲型流感病毒感染期间 NLRP3 炎症体诱导的炎症。J. Leukoc.101, 863-874 (2017).
Pinar, A. et al. PB1-F2 Peptide derived from avian influenza a virus H7N9 induces inflammation via activation of the NLRP3 inflammasome.J. Biol.Chem.292, 826-836 (2017).
Sermersheim, M. 等人 MG53 通过调节雷诺丁受体介导的细胞内钙信号传导抑制干扰素-β 和炎症。Nat.11, 3624 (2020).11, 3624 (2020).
Kenney, A. D. et al. 重组 MG53 蛋白保护小鼠免受致命流感病毒感染。Am.J. Respir.Crit.Care.Med.203, 254-257 (2021).
Ding, J. et al. 气孔形成活性和气孔蛋白家族的结构自抑制。Nature 535, 111-116 (2016).
Mulvihill, E. 等人. 人类 gasdermin-D 的膜孔形成机制.EMBO J 37, e98321 (2018).
Liu, X. 等人 炎症体激活的气敏素 D 通过形成膜孔引起热变态反应。自然》杂志第 535 卷第 153-158 期(2016 年)。
Gaidt, M. M. & Hornung, V. GSDMD 的孔隙形成是裂殖的效应机制。embo j 35, 2167-2169 (2016).
Aglietti, R. A. et al.Proc.Natl.USA 113, 7858-7863 (2016)。
Bent, R., Moll, L., Grabbe, S. & Bros, M. Interleukin-1 Beta-A Friend or Foe in Malignancies?Int.Int. J. Mol.19, 2155 (2018).
Vecchie, A. et al. IL-18 与感染:靶向疗法有作用吗?J. Cell.236, 1638-1657 (2021).
Orzalli, M. H. et al. IL-1 信号通路的抗病毒分支限制了免疫侵袭性病毒的复制。Mol. Cell 71, 825-840 (2018).Cell 71, 825-840 (2018).
Yu, P. et al.Signal Transduct.Target Ther.6, 128 (2021).
Kayagaki, N. et al. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling.Nature 526, 666-671 (2015)。
Shi, J. et al. 炎症性 Caspases 对 GSDMD 的裂解决定了细胞的猝死。Nature 526, 660-665 (2015)。
Rosli, S. et al. Gasdermin D 促进了严重甲型流感病毒感染期间的过度炎症和免疫病理学。Cell Death Discov.14, 727 (2023).
Robinson, D. P., Lorenzo, M. E., Jian, W. & Klein, S. L. 17β-雌二醇升高可通过抑制炎症反应保护女性免受甲型流感病毒致病作用的影响。PLoS Pathog.7, e1002149 (2011).
Menachery, V. D., Gralinski, L. E., Baric, R. S. & Ferris, M. T. New metrics for evaluating viral respiratory pathogenesis.PLoS One 10, e0131451 (2015).
Kenney, A. D. et al. 心肌细胞中的流感病毒复制导致心脏功能障碍和纤维化。Sci. Adv. 8, eabm5371 (2022).
单细胞转录组分析揭示了中性粒细胞在稳态和感染中的异质性。Nat Immunol.21, 1119-1133 (2020).
Okeke, E. B. 等人. 抑制中性粒细胞弹性蛋白酶可防止中性粒细胞胞外陷阱的形成并挽救小鼠免于内毒素休克。Biomaterials 238, 119836 (2020).Gramegna, A. et al. Neutrophil elastase in bronchiectasis. Respir. Res. 18, 211 (2017).
Sollberger, G. et al. Gasdermin D plays a vital role in the generation of neutrophil extracellular traps. Sci. Immunol. 3, eaar6689 (2018).
Hufford, M. M. et al. Influenza-infected neutrophils within the infected lungs act as antigen presenting cells for anti-viral CD8(+) T cells. PLoS One 7, e46581 (2012).
Chan, L. L. Y. et al. Host DNA released by NETosis in neutrophils exposed to seasonal H1N1 and highly pathogenic H5N1 influenza viruses. Respir. Res. 21, 160 (2020).
Ivan, F. X. et al. Neutrophils infected with highly virulent influenza H3N2 virus exhibit augmented early cell death and rapid induction of type I interferon signaling pathways. Genomics 101, 101–112 (2013).
Fiege, J. K. et al. Long-term surviving influenza infected cells evade CD8+ T cell mediated clearance. PLoS Pathog. 15, e1008077 (2019).
Hamilton, J. R. et al. Club cells surviving influenza a virus infection induce temporary nonspecific antiviral immunity. Proc. Natl. Acad. Sci. USA 113, 3861–3866 (2016).
Heaton, N. S. et al. Long-term survival of influenza virus infected club cells drives immunopathology. J. Exp. Med. 211, 1707–1714 (2014).
Chen, X. et al. Host Immune Response to Influenza A Virus Infection. Front Immunol. 9, 320 (2018).
Ma, Y., Zhang, Y. & Zhu, L. Role of neutrophils in acute viral infection. Immun Inflamm Dis 9, 1186–1196 (2021).
Tate, M. D. et al. Neutrophils ameliorate lung injury and the development of severe disease during influenza infection. J. Immunol. 183, 7441–7450 (2009).
Tate, M. D., Brooks, A. G. & Reading, P. C. The role of neutrophils in the upper and lower respiratory tract during influenza virus infection of mice. Respir. Res. 9, 57 (2008).
Tate, M. D., Brooks, A. G., Reading, P. C. & Mintern, J. D. Neutrophils sustain effective CD8(+) T-cell responses in the respiratory tract following influenza infection. Immunol. Cell Biol. 90, 197–205 (2012).
Tate, M. D. et al. The role of neutrophils during mild and severe influenza virus infections of mice. PLoS One 6, e17618 (2011).
Narasaraju, T. et al. Excessive neutrophils and neutrophil extracellular traps contribute to acute lung injury of influenza pneumonitis. Am. J. Pathol. 179, 199–210 (2011).
Sugamata, R. et al. Contribution of neutrophil-derived myeloperoxidase in the early phase of fulminant acute respiratory distress syndrome induced by influenza virus infection. Microbiol. Immunol. 56, 171–182 (2012).
Zhu, L. et al. High level of neutrophil extracellular traps correlates with poor prognosis of severe influenza a infection. J. Infect. Dis. 217, 428–437 (2018).
Xu, T. et al. Acute respiratory distress syndrome induced by avian influenza A (H5N1) virus in mice. Am. J. Respir. Crit. Care Med. 174, 1011–1017 (2006).
Brandes, M., Klauschen, F., Kuchen, S. & Germain, R. N. A systems analysis identifies a feedforward inflammatory circuit leading to lethal influenza infection. Cell 154, 197–212 (2013).
Liu, X., Xia, S., Zhang, Z., Wu, H. & Lieberman, J. Channelling inflammation: gasdermins in physiology and disease. Nat. Rev. Drug Discov. 20, 384–405 (2021).
Karmakar, M. et al. N-GSDMD trafficking to neutrophil organelles facilitates IL-1β release independently of plasma membrane pores and pyroptosis. Nat. Commun. 11, 2212 (2020).
Chen, K. W. et al. Noncanonical inflammasome signaling elicits gasdermin D-dependent neutrophil extracellular traps. Sci. Immunol. 3, eaar6676 (2018).
Kalil, A. C. & Thomas, P. G. Influenza virus-related critical illness: pathophysiology and epidemiology. Crit. Care 23, 258 (2019).
Force ADT et al. Acute respiratory distress syndrome: the Berlin definition. JAMA 307, 2526–2533 (2012).
Grommes, J. & Soehnlein, O. Contribution of neutrophils to acute lung injury. Mol. Med. 17, 293–307 (2011).
Xie, J. et al. GSDMD-mediated NETosis promotes the development of acute respiratory distress syndrome. Eur. J. Immunol 53, e2250011 (2023).
Silva, C. M. S. et al. Gasdermin D inhibition prevents multiple organ dysfunction during sepsis by blocking NET formation. Blood 138, 2702–2713 (2021).
Liu, F. et al. Neutrophil-specific depletion of gasdermin D does not protect against murine sepsis. Blood 141, 550–554 (2023).
Bauer, R. N. et al. Influenza enhances caspase-1 in bronchial epithelial cells from asthmatic volunteers and is associated with pathogenesis. J Allergy Clin Immunol. 130, 958–967 (2012).
Ichinohe, T., Lee, H. K., Ogura, Y., Flavell, R. & Iwasaki, A. Inflammasome recognition of influenza virus is essential for adaptive immune responses. J. Exp.Med. 206, 79–87 (2009).
Kambara, H. et al. Gasdermin D Exerts Anti-inflammatory Effects by Promoting Neutrophil Death. Cell Rep. 22, 2924–2936 (2018).
Porritt, R. A. & Hertzog, P. J. Dynamic control of type I IFN signalling by an integrated network of negative regulators. Trends Immunol. 36, 150–160 (2015).
Guo, X. J. & Thomas, P. G. New fronts emerge in the influenza cytokine storm. Semin Immunopathol 39, 541–550 (2017).
Teijaro, J. R. The role of cytokine responses during influenza virus pathogenesis and potential therapeutic options. Curr Top Microbiol Immunol. 386, 3–22 (2015).
Moltedo, B., Li, W., Yount, J. S. & Moran, T. M. Unique type I interferon responses determine the functional fate of migratory lung dendritic cells during influenza virus infection. PLoS Pathog. 7, e1002345 (2011).
Rauch, I. et al. NAIP-NLRC4 Inflammasomes coordinate intestinal epithelial cell expulsion with eicosanoid and IL-18 release via activation of caspase-1 and -8. Immunity 46, 649–659 (2017).
Lund, M. E., To, J., O’Brien, B. A. & Donnelly, S. The choice of phorbol 12-myristate 13-acetate differentiation protocol influences the response of THP-1 macrophages to a pro-inflammatory stimulus. J. Immunol. Methods 430, 64–70 (2016).
Ruifrok, A. C. & Johnston, D. A. Quantification of histochemical staining by color deconvolution. Anal. Quant. Cytol. Histol. 23, 291–299 (2001).
Kenney A. D. et al. Interferon-induced transmembrane protein 3 (IFITM3) limits lethality of SARS-CoV-2 in mice. EMBO Rep. https://doi.org/10.15252/embr.202256660 (2023).
Love, M. I., Huber, W. & Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biol. 15, 550 (2014).
Subramanian, A. et al. Gene set enrichment analysis: a knowledge-based approach for interpreting genome-wide expression profiles. Proc. Natl. Acad. Sci. USA 102, 15545–15550 (2005).
Mootha, V. K. et al. PGC-1alpha-responsive genes involved in oxidative phosphorylation are coordinately downregulated in human diabetes. Nat. Genet. 34, 267–273 (2003).
Shannon, P. et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Res 13, 2498–2504 (2003).
Gillespie, M. et al. The reactome pathway knowledgebase 2022. Nucleic Acids Res. 50, D687–D692 (2022).
Franzen, O., Gan, L. M. & Bjorkegren, J. L. M. PanglaoDB: a web server for exploration of mouse and human single-cell RNA sequencing data. Database (Oxford) 2019, baz046 (2019).
Kanehisa, M. & Goto, S. KEGG: kyoto encyclopedia of genes and genomes. Nucleic Acids Res. 28, 27–30 (2000).
Chen, E. Y. et al. Enrichr: interactive and collaborative HTML5 gene list enrichment analysis tool. BMC Bioinformatics 14, 128 (2013).
Kuleshov, M. V. et al. Enrichr: a comprehensive gene set enrichment analysis web server 2016 update. Nucleic Acids Res. 44, W90–W97 (2016).
Acknowledgements
Research in the Yount laboratory is supported by NIH Grants AI130110, AI151230, HL154001, HL157215, and an American Lung Association COVID-19 and Emerging Respiratory Viruses Research Award. AZ was supported by an NSF-GRFP fellowship grant. ADK and PJD were supported by an institutional T32 postdoctoral fellowship (NIH training grant AI165391). Research in the Forero laboratory is supported by NIH grant R35 GM150806. We thank Dr. Ryan Langlois (University of Minnesota) for supplying stocks of PR8-Cre.
Author information
Authors and Affiliations
Contributions
Conceptualization: A.O.A., C.C., J.M. and J.S.Y. Data Curation: A.F. and J.S.Y. Formal analysis: S.S., M.I.M., A.Z., A.S., A.D.K., R.R., E.A.H., A.F. and J.S.Y., Investigation: S.S., M.I.M., A.Z., A.S., S.L., J.E.R., A.D.K., H.B., L.Z., P.J.D., A.C.E. and E.A.H. Visualization: S.S., M.I.M., A.Z., A.S., A.D.K., A.F. and J.S.Y. Writing – Original Draft: S.S., M.I.M., A.Z., A.D.K., J.M., A.F. and J.S.Y. Supervision: J.S.Y. Project Administration: J.S.Y. Funding Acquisition: J.S.Y. Resources: A.O.A., C.C. and J.M.
Corresponding authors
Ethics declarations
Competing interests
The authors declare no competing interests.
Peer review
Peer review information
Nature Communications thanks Lisa Connor and the other anonymous reviewer(s) for their contribution to the peer review of this work. A peer review file is available.
Additional information
Publisher’s note Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Source data
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/.
About this article
Cite this article
Speaks, S., McFadden, M.I., Zani, A. et al. Gasdermin D promotes influenza virus-induced mortality through neutrophil amplification of inflammation. Nat Commun 15, 2751 (2024). https://doi.org/10.1038/s41467-024-47067-0
Comments
By submitting a comment you agree to abide by our Terms and Community Guidelines. If you find something abusive or that does not comply with our terms or guidelines please flag it as inappropriate.